
CNEWS匯流新聞網記者陳鈞凱/台北報導
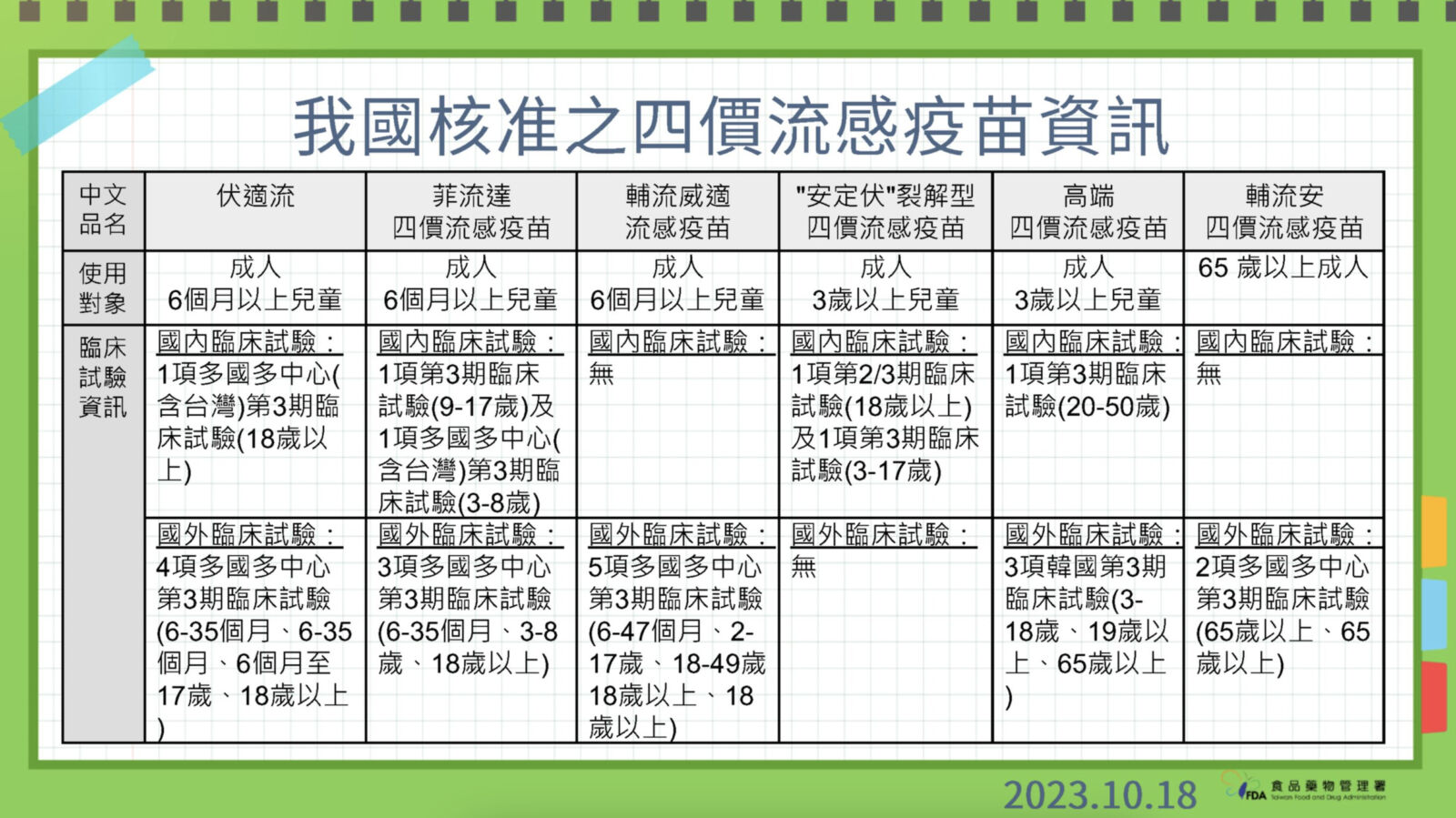
高端疫苗今年首度列入公費流感疫苗,爭議卻不斷,被國民黨立法委員王鴻薇質疑在台臨床試驗收案不全,又拒絕公開韓國原廠GC公司的疫苗資料。食藥署副署長陳惠芳今(18)日回應,國內審查全依照國際指引,其中,臨床試驗並未限定試驗執行的地點,全看廠商所附整體臨床試驗數據結果進行審查其療效及安全性,在不在台灣進行臨床試驗並非必要。
高端今年提供的流感疫苗,事實上是購自韓國的「GC Biopharma四價流感疫苗」原液後分裝製成,而GC公司生產的流感疫苗具有世界衛生組織(WHO)及韓國認證。但王鴻薇質疑,該疫苗僅針對20至50歲進行試驗,缺乏3至18歲、19歲以上及65歲以上的臨床數據,且向食藥署索取資料,又被食藥署以保密為由,拒絕公開GC公司的疫苗資料。
陳惠芳表示,跨國的疫苗廠由於因應不同地區,會採取原液分裝充填的方式,除非充填後的品質與原來不同,否則提供給各國主管機關審核的數據都會是同一組。高端在申請疫苗查驗登記時,檢附的臨床資料已經包括韓國執行第一、二期及第三期臨床試驗,受試者年齡包括3至18歲、19歲以上及65歲以上等,也在台灣執行第三期臨床試驗,受試者年齡為20至50歲。
陳惠芳說,國內審查是依據國際的ICH E5指引所訂的銜接性試驗基準,來審視藥品是否具有族群差異,若經評估無族群差異者,可以引用國外臨床試驗數據資料,並未要求必須於台灣執行臨床試驗或執行全年齡層的臨床試驗,以減少重複進行臨床試驗。
陳惠芳強調,目前國內核准的6種四價流感疫苗,全依據上速相同標準進行審查,像是台灣東洋的流感疫苗,檢附數據同樣包含亞洲人種,因此也沒有另外在國內進行臨床試驗。
至於資料保密不公開一事。陳惠芳說,依據藥事法第40條之1及營業秘密法第2條規定,藥品查驗登記時所檢附原始數據屬營業秘密的資料,食藥署應保密;食藥署作為藥品審查主管機關,依規定針對四價流感疫苗製程管控、藥毒理試驗及臨床試驗結果進行嚴謹審查,確認其品質、安全及有效性後才會核發藥品許可證,且逐批疫苗放行前,須經檢驗封緘,檢驗10到11項檢驗,經檢驗封緘合格放行後,才會供國人接種,國人可以安心。
照片來源:CNEWS資料照/記者陳鈞凱攝
《更多CNEWS匯流新聞網報導》
美豬「洗產地」銷往6縣市下肚 食藥署最新瘦肉精檢驗結果出爐!
義大利「松露」恐禁入台灣!7次重金屬超標 食藥署限期15天給說法
【文章轉載請註明出處】
延伸閱讀
知名「喇叭牌正露糖衣錠」爆2異常! 食藥署發布回收68萬錠
- 2025-04-01
- 陳 鈞凱
裕毛屋「米油」爆致癌汙染物超標! 聯馥食品「乾酪」也大腸桿菌違規
- 2025-04-01
- 陳 鈞凱
罐裝可樂出包「恐致腎衰竭」香港、英國都召回! 食藥署:台灣沒進口
- 2025-03-27
- 陳 鈞凱
